中國網/中國發展門戶網訊 萜類化合物是由異戊二烯單元組成的有機化合物,已知結構超80000種,具有多樣的生物活性。根據異戊二烯單元數量的不同,萜類化合物被分類為單萜、倍半萜、二萜、二倍半VR虛擬實境萜、三萜、四萜等,具有復雜多變的空間結構和多樣的理化性質與生物學功能。例如,倍半萜青蒿素是具有抗瘧活性的諾(貝爾)獎級藥物,二萜紫杉醇是抗癌領域的“明星”藥物,三萜角鯊烯具有保濕和滲透功效,四萜蝦青素具有顯著抗氧化作用。這些獨特的性質使得萜類化合物在醫藥、香料、化妝品、食品添加劑等領域有廣泛應用。
隨著合成生物學的蓬勃發展,萜類化合物的研究與開發正逐步成為推動生物科技創新、加速產業升級的重要力量。然而,在這一進程中,也存在著諸多挑戰。一方面,隨著基因組測序技術的日益成熟,互聯網上匯聚了海量的未鑒定合成酶資源,如何高效挖掘并充分利用這些寶貴資源成為亟待解決的問題。另一方面,盡管萜類化合物的高產菌株的構建已不再遙不可及,但如何實現高產菌株的規模化生產,推動其產業化制造與商業化應用,仍是一項必須面對的關鍵挑戰。
萜類化合物的高效發現
在“第三次生命科學革命”的浪全息投影潮中,天然產物作為藥物的重要來源,其發掘工作正經歷著深刻變革。面對全球性多藥耐藥問題的挑戰和現代藥物開發的需求,傳統的依賴生物樣本分離提取的方法已難以滿足當前需求。隨著計算能力的提升、基因組層面技術的發展、微生物培養技術的成熟,以及高通量自動化平臺的建立,天然產物在藥物先導化合物的探索中再次受到重視,并開辟了新的機遇。
萜類化合物的高效發現,作為生物學科的關鍵研究方向之一,不僅能夠豐富天然產物資源,更能促進相關產業的技術革新和產品升級。目前,主要通過3種方法來挖掘萜類化合物:直接從天然來源提取、激活沉默基因廣告設計(簇)和異源表達。這些方法的綜合應用極大地促進了萜類化合物的發現。然而,已鑒定萜類合酶和萜類化合物仍然只是自然界中龐大萜類資源的一小部分。當前研究的焦點是如何突破萜類化合物挖掘過程中的“三低”難題——低產量、低結構新穎性和低研究效率,并在此基礎上發展出更高效的策略來進行挖掘(圖1)。
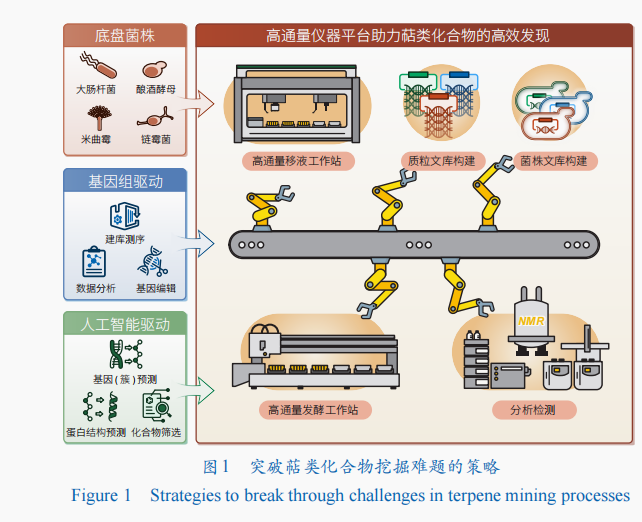
高效前體供給底盤提供挖掘動力
異源表達玖陽視覺是一種通過引入外源生物合成基因(簇)到具有成熟遺傳操作的生物體中,以揭示其功能的方法。這種方法解決了原始宿主不可獲得和遺傳操作困難的問題,被廣沈浸式體驗泛應用于萜類化合物的挖掘和生物合成途徑的解析,并實現了多種明星萜類分子的從頭合成(表1)。選擇策展異源宿主時需綜合考慮其生長速度、代謝背景、遺傳操作便利性和對目標化合物的耐受性。常見的宿主包括大腸桿菌、酵母、鏈霉菌、絲狀真菌和模式植物煙草等。然而,受限于異源宿主的合成能力,僅能鑒定豐度高的產物,而豐度低的產物易被忽略或難以獲取,這限制了對萜類合酶及其后修飾酶的全面認知。因此,改造異源宿主開發高效供給萜類前體的底盤菌株,提高產物的豐度和多樣性,對新萜類化合物的挖掘具有重要意義。

大腸桿菌底盤。大腸桿菌因其遺傳操作簡便和生長快速而備受青睞。利用“定向合成代謝”的概念,基于體外催化的結果指導體內代謝途徑的改造,研究人員構建了高產異戊烯焦磷酸(IPP)和烯丙基焦磷酸(DMAPP)的大腸桿菌底盤。在此展場設計基礎上,通過組合不同異戊二烯前體和萜類合酶充分釋放真菌來源萜類合酶FgGS和FgMS的合成潛力,研究人員檢測到50種萜類化合物,鑒定了包括大圖輸出3種新骨架的8個新化合物。
酵母底盤。酵母作為最易操作、研究透徹的真菌生物,已被廣泛應用于萜類化合物的挖掘。利用增強了內源甲羥戊酸(MV模型A)途徑的酵母底盤菌株,研究人員高通量系統挖掘了74個真菌嵌合萜類合酶,其中34個具有活性,共產生了24種二萜和二倍半萜化合物,包括2種新的二倍玖陽視覺半萜;并在此基礎上,進一步顛覆性發現了非角鯊烯來源的三萜合成全新途徑。該策略還可以運用到植物的萜類合酶的挖掘中,通過在高效底盤中表征艾蒿來源的29個萜類合酶,研究人員發現了一個新倍半萜骨架和具有優秀驅蟲活性的艾蒿醇(Intermedeol)。
絲狀真菌底人形立牌盤。絲狀真菌因其內含子正確識別剪切和蛋白分泌能力,是真菌源萜類生物合成基因(簇)異源表達的理想宿主。在基于微生物高產底盤的天然產物創新挖掘策略的基礎上,研究人員進一步提出“一把鑰匙開一把鎖”的研究理念,選用釀造行業中最古老、應用最廣泛的米曲霉作為近源宿主挖掘了5株真菌的全部萜類合成基因簇,并構建了高效通用底盤,解決了異源表達適配FRP性低和產量低的問題。
鏈霉菌底盤。鏈霉菌能夠合成種類繁多、數量龐大的次級代謝開幕活動產物,不但具有合成天然產物所需要的各種前體,還具備多類型產物耐受性和完善的修飾系統。鏈霉菌不僅可以用于萜類合酶的挖掘,還可用于細胞色素P450等后修飾酶的表征。通過刪除高產鏈霉菌中的阿維菌素及萜類等內源代謝物相關基因,簡化遺傳代謝背景和避免前體競爭,研究人員在異源表達細菌來源沉默萜類合酶時,成功鑒定到13個新萜類化合物。
植物底盤。植物是天然藥物的重要來源,具備精細分隔的細胞結構以支持膜定位外源酶的功能,同時擁有全面的翻譯后修飾系統,并具有安全性高、培養成本低等特點。利用模式植物煙草,研究人員以底物喂養和建立篩選底盤2種方式鑒定了紫杉醇合成途徑的關鍵化合物和基因,實現了關鍵中間體baccatin Ⅲ在煙草中的從頭合成,展示了植物宿主挖掘植物來源復雜萜類生物合成基因(簇)方面的優勢。
基因組與高通量協同優化挖掘策略
隨著測序技術的飛速發展,全球基因組數據量激增,海量的基因組數據沉淀在互聯網,亟待研究人員的挖掘,這使得基因組深度挖掘逐漸成為探索生命奧秘的一把鑰匙。它能夠直接從基因組數據中挖掘潛在的生物合成基因簇(BGC),以其獨特的視角透視生物體內在的遺傳信息,揭示微生物和植物中未被充分利用的化學多樣性,擴展天然產物高效發現的深度。
然而,天然產物的高效發現并非易事,它依賴于速度與效率的雙重提升。生物信息學的分析雖然提供了海量的信息,但其中不乏冗余,需要大量的實驗驗證來去偽存真。目前,數十萬個分析歸檔的BGC中,僅不到0.25%進行過實驗表征和產物確定,這一現狀無疑制約了天然產物發現的步伐。
為了打破這一瓶頸,自動化高通量技術應運而生。它通過海量的工程化試錯實驗,取代傳統的勞動密集型研究范式,能夠快速、低成本、多循環地完成“設計—構建—測試—學習”的閉環,成為天然產物的自動化高效挖掘和高效構建高附加值化合物細胞工廠的解決方案。目前,國內外多家企業及科研院校均已建成高通量篩選平臺,實現了自動化基因編輯、菌株構建和高通量菌株篩選等功能,提高了天然產物挖掘的效率。
利用基于米曲霉底盤的高通量平臺,研究人員系統性挖掘了5株絲狀真菌中的萜類BGC,實現了從質粒構建、基因簇重構到活性篩選的全流程自動化實驗,將39個萜類BGC自下而上重構至208個突變株中,檢測到185個萜類產物,將實驗周期縮短至29天,在活性篩選階段發現了具有顯著抗炎活性的二倍半萜Mangicol J并揭示了其生物合成機制。在靈芝酸研究中,研究團隊利用釀酒酵母高通量基因編輯平臺,一次性構建了158個可能的細胞色素P450過表達質粒庫,經3輪迭代菌株構建,挖掘到2種能夠將Ⅰ型靈芝酸轉化為Ⅱ型靈芝酸的P450,成功解析了靈芝酸生物合成途徑中關鍵酶。該創新性萜類挖掘策略結合基因組挖掘、高效底盤和高通量平臺,不僅突破了傳統挖掘方法通量低的限制,更為天然產物的發現與利用開辟了新的道路。
人工智能革新挖掘方式
現代科學研究中,人工智能(AI)以其卓越的數據處理能力和模式識別技術,為天然產物的發現與研究帶來革命性的突破。機器學習與深度學習的快速發展,不僅使研究人員能夠高效地處理和解析海量的化學、生物學和藥理學數據,還能夠精確預測化合物的生物活性及潛在毒性。這一技術革新覆蓋了從基因組和代謝組挖掘、結構表征到靶點和生物活性預測等多個關鍵環節,引領著天然產物研究向更深層次的科學探索邁進。
在基因組挖掘領域,預測BGC是發現復雜次級代謝產物微生物的關鍵步驟。傳統的BGC預測算法,如CLUSEAN、SMURF和antiSMASH等,舞臺背板能夠在一定程度上識別與已知生物合成途徑高度相似的區域,但在面對未知的全新基因簇時力不從心。相比之下,機器學習算法在此類任務中有顯著優勢。例如,Moore等整合了自動化機器學習框架AutoGluon-Tabular和來自擬南芥的多組學數據,以預測參與植物次生代謝物如萜類、生物堿和酚類的BGC,鑒定了擬南芥中1220個此前功能未知的基因。又如,Liu等利用antiSMASH和DeepBGC同時分析馬鈴薯致病菌瘡痂鏈霉菌的基因組,后者預測到額外的112個BGC,展示了人工智能在新型基因簇識別方面卓越的性能。
除了BGC預測外奇藝果影像,蛋白質功能預測也是天然產物發現的重要一環。在這一領域,AlphaFold作為一款深度學習軟件,成功模擬了氨基酸之間的復雜相互作用,并準確預測蛋白質的最終折疊形態。AlphaFold到AlphaFold3的迭代更新,不僅提升了預測的精度和效率,也為靶點治療、新藥研發,以及合成生物學等領域提供了重要的工具支持。值得一提的是,AlphaFold在蛋白質功能預測方面的應用,為萜類合酶的預測結構提供了高精度的快速解決方案。研究人員可以借此技術,指導進行蛋白質功能預測,從海量的蛋白數據庫中迅速篩選出具有巨大潛力的候選蛋白,為后續的濕實驗提供有力的指導,從而挖掘出全新的同類萜類合酶。
新天然產物功效和靶點不明,且活性實驗耗時冗長,阻礙了新藥研發的進程,AI助力的天然產物高通量篩選可打破這一局面。一方面,AI通過整合和學習化合物結構與毒性、活性之間的關聯,通過識別相似藥效團預測新化合物理化性質和生物活性。另一方面,通過AI算法可以從多層面多角度大規模預測天然產物與潛在靶點間的相互作用,加速苗頭化合物的發現,促進萜類化合物高效發現走向新藥研發的展場設計進程。機器學習技包裝設計術,如支持向量機(SVM)、隨機森林(RF)、貝葉斯等算法已被成功應用于藥物發現階段的化合物篩選環節,幫助改善藥物活性、預防藥物副作用,并發現新靶點。
盡管AI在藥物研發領域,尤其是先導化合物的發現和優化上取得了大量進展,但在萜類場地佈置化合物領域,目前成功應用案例尚少。在未來的研究中,AI有望從萜類化合物中挖掘出更多的新藥候選物,為人類的健康事業貢獻力量。
萜類化合物的產業化制造
在萜類化合物的產業化制造領域,傳統方法如化學合成、植物提取及天然含目標化合物的微生物發酵,雖各有其應用,卻均面臨顯著局限。化學合成雖能實現大量生產,但步驟繁瑣、能耗高且伴隨有害副產品,對環境保護和可持續發展構成挑戰。植物提取受限于生長周期、地域分布及含量有限,難以滿足大規模生產需求。天然微生物發酵則因產量低、提取成本高而應用受限。
隨著合成生物學技術的蓬勃發展,萜類化合物的產業化制造迎來了革命性發展。科學家通過巧妙設計并改造細胞工廠,成功將可持續的生物質能轉化為具有復雜化學結構和強效活性的特定萜類化合物,不僅彌補了傳統制造方法的短板,更開辟出一條綠色、可持續且高效的產業化新路徑。
合成生物學助力萜類化合物生物制造
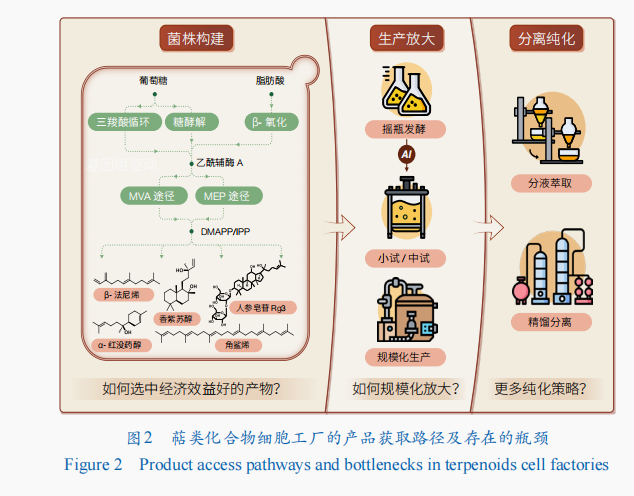
在萜類化合物生物制造產業化進程中,萜類化合物細胞工廠的產品獲取路徑涵蓋菌株構建、生產放大、分離純化三大關鍵環節(圖2)。這一過程的本質在于,要確保細胞工廠具備超凡的生產速率,力求達到甚至超越植物提取、化學合成等傳統工藝的水準。盡管兩相發酵以進行原位萃取的策略可以顯著提高小分子萜類的生產水平,但為了比較容易地純化到最終產品,萜類化合物的生產滴度至少需達到克級每升的水平(表2),這無疑對萜類化合物的產業化提出了嚴苛的要求。針對萜類化合物的生產速率這一核心瓶頸,科學家們開發出一系列創新策略。
生物合成宿主的選擇。隨著CRISPR 基因編輯技術的精進和全基因組序列信息的豐富,研究人員采用系統生物學方法對微生物制造工廠進行改良和創新,以實現萜類的高效合成。其中,大腸桿菌、釀酒酵母作為研究最為深入、代謝大型公仔背景最為清晰的模式菌株,已實現多種萜類的高產。特別是釀酒酵母,憑借其表達高等真核生物基因的能力、單細記者會胞組成的便捷操作性,以及實驗室適應性進化賦予的可控性突變,成為萜類化合物生物制造的主力軍。
生物合成途徑的重建。釀酒酵母中萜類化合物的合成以自身天然存在的MVA途徑為核心,分別向上游的乙酰輔酶A供給和下游萜烯單體DMAPP/IPP利用進行延伸。通過增強整個MVA途徑,全局代謝網絡調控增加或者多元化乙酰輔酶A的供給,抑制旁路的競爭代謝途徑使更多的萜烯單體流向最終產物,平衡調控合成途徑中的輔因子和能量供給等策略,研究人員實現了諸多萜類化合物的高產。
生物合成酶的工程改造。萜類合成途徑下游的修飾酶是萜類結構復雜多樣的關鍵。在原生生物體內,這些酶不僅催化特定反應,且整個途徑受到復雜的機制調控,使其直接進行異源表達時,會造成生物合成步驟功能解耦,以及合成不良副產物等風險。通過酶工程實現理性設計,可以極為有效地提高酶的表達水平、催化效率和反應特經典大圖異性。與此同時,可借鑒其他合成途徑中的多酶級聯自組裝策平面設計略,實現上下游途徑的強耦合,以及解決底物傳遞和代謝流不穩定等問題。
生物合成的靶向定位。萜類化合物結構的多樣性極易引發細胞毒性,限制單萜的產量提升;并且,隨著碳鏈延長造成的親脂性的增強,三萜和四萜趨向于在特定亞細胞區室中積累。通過將整個生物合成途徑定位到亞細胞器(線粒體FRP、過氧化物酶體等),能夠實現對中間毒性產物的區室化隔離,并對亞細胞器中豐富的乙酰輔酶A加以利用。此外,脂滴工程儲存毒性疏水性萜類前體,內質網工程提高蛋白質的折疊合成和容納空間,對代謝途徑的精準調控都展現了極大的應用潛力。
合成生物學推進萜類化合物產業化
在這些策略的加持下,萜類化合物細胞工廠的建造變得觸手可及,但仍需面臨一個關鍵問題:如何從眾多通過高效發現手段篩選出的萜類化合物中,挑選出既具備廣闊市場前景,又能彰顯生物制造成本優勢,從而帶來顯著經濟效益的品種?面對這一挑戰,既要著眼于實驗室內的技術革新,更要深入剖析市場走向與經濟可行性。
一種行之有效的策略是,聚焦那些市場需求明確的萜類化合物,通過優化菌株和生產工藝,實現產量的最大化。對于大宗化合物而言,生物制造的單萜在經濟效益上或許難以與現有的傳統成熟工藝相媲美。然而,在更為復雜的十五碳及以上的萜類化合物領域,生物制造卻展現出令人驚喜的成效(表2)。從倍半萜中的用于香精香料領域的β-法尼烯、具有抗炎舒緩活性的(–)-α-紅沒藥醇,到二萜中龍涎香醚主要合成前體的二萜香紫蘇醇,再到三萜中生物全合成注射級疫苗佐劑角鯊烯、具有多種藥物特性的稀有人參皂苷,以及四萜中的類胡蘿卜(如番茄紅素、β-胡蘿卜素、蝦青素)等,眾多萜類化合物已成功打通了從實驗室設計到商業化生產的全鏈條。
表2 合成生物學助力萜類化合物的產業化進程
另一種富有前瞻性的策略是,通過生物制造滿足特定市場需求的全新化合物。在生物制造航空燃料的探索中,研究人員利用細胞工廠快速合成了17個經過理論計算篩選過的倍半萜化合物,并對這些高能液體燃料候選分析進行了系統性的高效評估。這種將細胞工廠與高效發現策略相結合的方法,為拓展到其他細分領域提供了無限可能。
合成生物學與化學合成的深度融合
盡管合成生物學在萜類化合物生物合成方面取得了顯著進展,但仍有部分高活性的植物源萜類化合物(如紫杉醇)的生物合成途徑難以挖掘,VR虛擬實境這在一定程度上制約了其產業化進程。然而,隨著對生物合成和化學合成認識的不斷加深,科學家們開創性地提出了結合兩者優勢的新策略。
這一策略利用現有的天然產物類似物參展和最低限度的化學催化,來合成特定的天然產物,有效解決了從復雜天然產物中經濟地生產候選藥物的難題。美國Amyris公司在釀酒酵母中高產青蒿素前體青蒿酸的實踐,就是這一策略的成功典范。遺憾的是,由于市場需求變化等外部因素,Amyris公司的商業化進程遭遇挫折,但這一思路無疑為萜類化合物的產業化開辟了包裝設計全新路徑。
在此基礎上,科學家們進一步拓展了那些只停留在高產階段,而無法進入產業化階段的化合物的全新運用,實現了其高附加值提升。具有顯著抗腎癌活性的Englerin A的大量生產啟動儀式難題,通過微生物合成的愈創木酚-6,10(14)-二烯作為關鍵前體實現化學半合成得到解決。具有葡萄柚香味的高附加值產品活動佈置圓柚酮,利用在釀酒酵母體內高產的倍半萜化合物瓦倫烯一步化學合成,實現了產業化的新途徑。此外,還能利用類似于化學合成式發散探索的新策略,以生物制造的香葉基香葉醇為出發底物,通過化學合成創制抗潰瘍藥物替普瑞酮、骨質疏松癥治療藥物Menaquinone-4,以及營養品α-生育三烯酚的全新合成途徑。
合成生物學在化學半合成領域的應用,不僅實現了復雜天然產物的創制,更能對傳統工業生產模式產生顛覆性影響。以維生素E為例,其化學結構中包含萜類結構單元,傳統上依賴化學法合成。而現在通過微生物發酵合成的法尼烯作為前體,化學合成獲得維生素E的關鍵中間體異植物醇,并最終合成維生素E。這一創新性技術的突破,打破了國外長期壟斷的化學全合成技術,標志著合成生物學在天然產物合成領域的重大進展。
細胞工廠規模化放大的障礙
在萜類化合物的高效發現與產業化制造領域,上游菌株構建技術已實現了豐富的技術儲備,并取得了顯著進展。然而,在下游環節,特別是規模化生產與分離純化方面,仍面臨重大挑戰,成為制約產業發展的瓶頸(圖2)。
規模化放大的困境。從實驗室的搖瓶發酵(僅50 mL)到工廠規模的噸級生產,萜類化合物的產業化之路存在大量挑戰。這一過程中,需要依次經歷實驗室小試(約5 L)、中試(接近工業化生產的500 L)等多個環節,直至最終的規模化放大。這些環節中,需要依次摸索最佳的培養基、溫度、pH值、溶氧控制、乙醇積累、補模型料策略等條件,以確保工藝在放大過程中的穩定性和可重復性。然而,發酵罐的實時監測和調控任務繁重且高度依賴工作人員經驗。在此背景下,人工智能技術的引入能夠加速確認調控操作與菌株代謝特性之間的復雜關系,推進產物合成,從而在規模化放大過程中保持產量和質量一致性。
分離純化的難題。雖然加入有機相進行兩相發酵可顯著提高產量,但易在發酵過程中形成穩定的乳化現象,使有機相和水相分離困難,造成總產量的損失,以及精制困難。開發與發酵過程集成的在線油分離技術,從而允許如細胞重復使用等策略或許能成為破乳的關鍵。完成破乳后,還需進行純化。當前,工業上普遍采用高能耗的精餾塔進行分離,但該技術依賴大型設備,與實驗室規模脫節。因此,加強科研機構與企業之間的緊密合作,深化產學研融合,成為推動技術創新與產業升級的必然選擇。同時,探索更多高效分離策略也顯得尤為重要,如超臨界流體萃取技術的開發及新型固相萃取試劑的研究等,這些新技術和新方法都有望為萜類化合物的分離純化提供全新的解決方案。
結語
隨著合成生物學技術的日新月異,萜類化合物這一自然界中極具潛力的化學寶藏,其高效發現與產業化制造正步入一個嶄新的發展階段。在發現方面,創新策略,如高效前體供給底盤開發、基因組與高通量技術協同優化及人工智能應用,加速了萜類化合物的篩選優化,為產業化打下堅實基礎。在制造方面,盡管高效細胞工廠的構建已不再成為制約產業發展的瓶頸,但在產物的選擇、規模化放大、分離提純等方面,仍面臨諸多挑戰。如何進一步優化生產工藝,提高產物純度與產量,降低成本,是當前亟待解決的問題。
然而,在萜類化合物產業化制造快速發展的同時,也必須清醒地認識到,目前萜類化合物的研究更集中于學術界,眾多萜烯的實際應平面設計用價值未得到發揮,因此推進其產業化至關重要。為此需要采取一系列措施,以推動學術實現產業轉化。鼓勵以市場為導向的應用型科研,建立科研院所與企業的長期合作關系,調整研究方向以滿足市場需求,實現資源共享與優勢互補。引入跨學科教育模式,培養既懂科研又懂市場的復合型人才,促進產學研融合,消除科研與市場間的信息障礙。提供技術和資金支持,制定利于成果轉化的政策,規范行業發展。通過技術交流會、展覽、論壇及現代媒體,加大成果推廣力度,提升公眾認知和市場認可度。
與此同時,對企業而言,萜類化合物的產業化進程仍面臨法律法規不完善、知識產權保護不足等挑戰。加快政策革新,推動完善生物制造產品的法律法規,精簡商品化審批流程,以促進產業的快速發展,提高企業的創新積極性。進一步強化知識產權保護體系,加大對技術模仿與侵權行為的打擊力度,保護創新者的合法權益,為創新者營造公平、公正的競爭環境。
展望未來,合成生物學技術將持續推動萜類化合物產業化制造邁向更廣闊的前景。通過持續的創新突破,將進一步降低成本、提高產量與純度,滿足市場需求,推動產業升級。期待看到更多成功案例的涌現,為生物經濟注入新活力,引領科技新時代。
(作者:池豪銘、鄂麗影,武漢大學藥學院;劉天罡,武漢大學藥學院 上海交通大學生命科學技術學院。《中國科學院院刊》供稿)
發佈留言