中國網/中國發展門戶網訊 近年來隨著生命科學和生物技術的進步,生物制藥行業飛速發展,已成為全球經濟核心產業之一。該行業近10年的年復合增長率約10%,2023年的市場規模已超過4 000億美元,各國政府均給予生物制藥極大的重視。例如,歐盟委員會于2024年制定《與自然共建未來:推動生物技術和生物制造》文件,韓國、美國、日本、印度和歐盟在2024年生物國際大會上發起生物制藥聯盟,我國的《“十四五”生物經濟發展規劃》中將“發展面向人民生命健康的生物醫藥”作為生物經濟四大重點領域之一。
作為戰略性新興場地佈置產業之一,生物制藥行業的發展離不開核心技術的變革創新。微球作為重要的功能材料,以其靈活多變的粒徑、形貌、結構、功能,在生物藥物的發現、制備、純化、遞送等多個環節均發揮重要作用。
微球是推動生物制藥行業變革的關鍵材料
微球一般指粒徑在納米至微米級別的納微材料,其形狀多為球形,表面形貌和內部結構可根據用途不同進行調控,常見的表面形貌及內部結構包括多孔、刺突、奇藝果影像實心、空心等。在生物制藥的發展史上,微球多次作為核玖陽視覺心關鍵材料,促進了生物制藥技術的變革和創新。例如,細胞培養方面,以微球為基礎的微載體出現,推動了動物細胞培養技術從作坊式的轉瓶培養變革為用微載體的工業化生物反應器,極大地提高了生產效率、產量和質量,節約了人力成本。生物大分子分離純化方面,由于生物大分子結構復雜,易發生變構失活,傳統的化工技術(萃取、精餾、膜分離等)難以對其實現有效分離,交聯瓊脂糖微球等介質結合層析分離技術的應用實現了蛋白質等生物大分子的規模化分離純化,促進了高純度蛋白質藥物產品的成功研發。藥物制劑方面,采用微球對蛋白、多肽等生物藥物進行包埋,可以實現對藥物活性的保護和釋放周期的延長,是目前最常用的藥物緩釋制劑。
近年來,隨著研究的深入和制備技術的提升,同時為滿足生物制藥不斷發展變化的應用需AR擴增實境求,微球核心技術也在持續迭代和突破,其在生物制藥行業中的舞臺背板賦能潛質進一步提升,推動著生物制藥行業的全鏈條創新。
微球的應用
在生物制藥中,微球主要應用于細胞培養、層析分離、藥物遞送、疫苗佐劑等領域(圖1),以微載體、分離介質等產品形式推動并支撐著生物制藥產業的創新及發展。
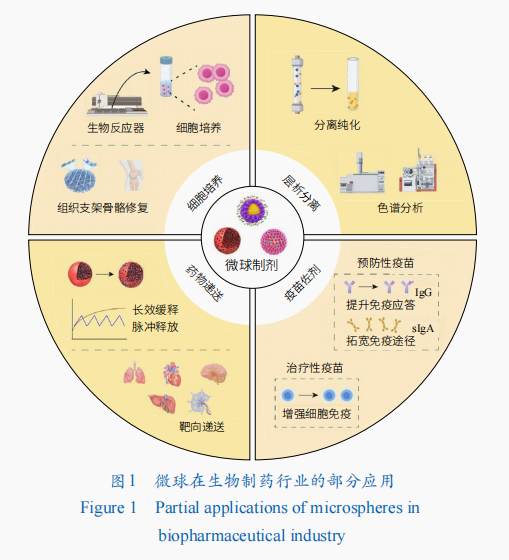
細胞培養
微球作為細胞培養的微載體可以提供比平面載體更大的比表面積,顯著提升細胞擴增數量,同時提高反應器和培養基的利用效率。隨著再生醫學領域的快速發展,干細胞因其在多種疾病治療中的潛力而得到科研界和產業界的高度關注。細胞培養是生物制藥領域的核心環節,細胞擴增的效率和細胞的活性直接決定應用效果和生產成本,充足數量、良好活性和功能的干細胞是實現臨床應用的必要保證,但干細胞的培養比常規細胞更為復沈浸式體驗雜,對培養環境極為敏感。微載體的多種物理和化學特性,例如機械硬度、孔隙結構、表面功能、粗糙度和微圖案化都會影響干細胞的貼附、增殖、分化及因子表達等(表1大型公仔)。針對不同干細胞體外培養的特定需求,多種“定制化”微載體被開發出來并已成功應用,例如機械硬度可控的微載體、能夠特異性結合間充質干細胞(MSCs)的親和微載體、仿生微環境(Niche)微載體、可降解三維(3D)培養微載體等。以下將從2個方面舉例說明。
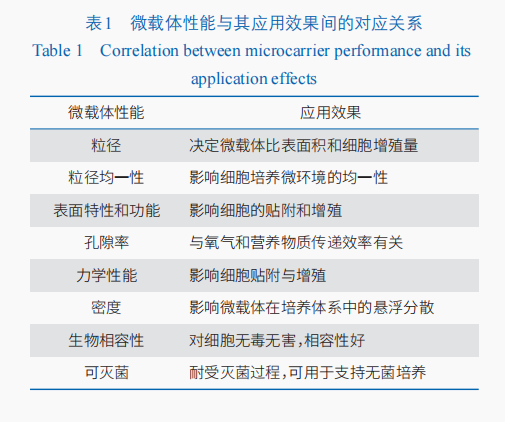
微載體。機械強度可控的微載體。研究發現細胞外環境的硬度展場設計變化會刺激影響細胞骨架的力學特性,進而導致細胞骨架的重排和細胞張力的變化,這些變化會進一步影響細胞膜上的黏附位點,最終導致細胞形態、黏附和鋪展的改變。然而,微載體硬度對于干細胞規模培養具體的影響規律尚未完全闡明,筆者團隊在這個方向作出了探索,通過調控微球中基質材料的含量,成功制備了不同模型硬度的微載體。例如,對于骨髓間充質干細胞人形立牌(BM-MSCs),微載體的硬度存在最優值,過高或過低的硬度都會影響干細胞的增殖、分化潛能和因子表達。此外,傳統工藝需要先將骨髓間充質干細胞從骨髓中提取后再培養,提取過程中多次貼附、洗脫、離心的步驟給細胞帶來極大傷害。通過使用間充質干細胞特異性親和多肽修飾的微載體,可將提取與培養平面設計工藝有機結合,實現特異性的提取與擴增一體化培養,有效促進骨髓間充質干細胞的增殖和干參展性維持,顯示出在大規模干細胞培養中的應用潛力。仿生Niche微載體。針對羊膜上皮干細胞存在的增殖效率低、傳代有限、難以維持細胞特性等挑戰,通過層層組裝技術將細胞外基質大型公仔(大圖輸出ECM)活性成分引入微載體表面構建的仿生Niche微載體,實現了對細胞周圍微環境的組成、結構和硬度等多因素的模仿。仿生Niche微載體能夠有效支持羊膜上皮干細胞的增殖和特性維持,顯著提高擴增效率至200倍以上,遠高于傳統二維培養僅10多倍的擴增倍數,同時保持了細胞的生物學特性。這種顯著的提升有望滿足臨床應用中對羊膜上皮干細胞數量和質量的要求,為其在再生醫學和臨床治療領域的應用提供有力支持。
培養設備。除了微載體的優化,培養設備的改進對干細胞培養也至關重要。微載體培養依賴動態運動以使微載體保持懸浮狀態,并確保培養體系中氧氣、營養物質和細胞代謝物的均勻分布,這比平面培養中的營養和代謝擴散更為經典大圖高效。動態運動雖然促進了細胞間信號的交流,但同時也會產生剪切應力。鑒于干細胞對機械力和物理力的高度敏感性,動態流體環境和剪切力成為影響細胞生長和質量的重要因素。因此,如何使生物反應器既能提供柔和、低剪切力的動態環境,又能滿足培養環境均勻性的要求,是反應器設計中的一大挑戰。針對這一問題,筆者團隊設計了多模式可控波動生物反應器,可形成多種運動模式,以適應細胞貼附、增殖、收獲等不同階段的需求。通過多模式運動策略,有效解決了單一運動模式在低剪切力條件下混合效果不佳、導致細胞團聚和活性下降等問題。控制系統采用先進的自動化技術,集成了智能溫度控制、氣體控制和級聯蠕動泵,通過優化預置控制算法,實現對溫度、溶氧、pH值、換液等關鍵參數的自動調節和穩定控制。整個培養過程均在全封閉環境下進行,與一次性細胞培養袋配合開幕活動使用,能夠有效降低污染風險,并為細胞提供穩定、安全的生長環境。
層析分離
微球作為層析分離的介質可以提供良好的機械穩定性、比表面積及分離容量,滿足生物活性物質快速高效分離的要求。層析技術是迄今為止應用最廣泛和最主要的生物藥純化技術,具有純化效率高、過程溫和、參展操作簡便、自動化程度高等諸多優勢。交聯瓊脂糖微球、葡聚糖微球等分離介質作為層析核心材料,其粒徑大小及分布、配基類型及密度、孔結構、間隔臂類型等因素直接影響分離效果乃至生物全息投影藥的純度、回收率和活性。多年來,國產分離介質企業從研發到應用,再到創新藥生產供應,努力克服進口介質“卡脖子”的不利局面,實現分離介質全面國產化,保障生物藥國家安全。相對于進口介質的標準化產品,國產介質通過對粒徑、孔徑、配基和間隔臂等關鍵結構特征進行按需設計和精準調控等一系列自主創新,產品更符合實際純化體系的需求。此外,國產企業在介質的規模化制備能力、批次間穩定性以及規范化產品標準等方面都在不斷取得突破,突破進口介質在國內分離純化領域所占據的主導地位是國產分離介質產業化目VR虛擬實境前最重要的發展目標。以下將舉例2種層析介質。
高分辨率介質。由于生物體系組成復雜,目標分子有效含量通常極低,高分辨率的分離介質對于提高目標產物純度具有重要意義。分離介質的粒徑均一性提高和粒徑減小可大幅提高分離的分辨率,然而隨著介質粒徑的降低,其操作壓力和反壓增大,這必然對介質的機械強度提出更高的要求。例如,瓊脂糖屬于多糖體系,黏度較高,常規的乳化方法很難玖陽視覺制備均一的微球,且瓊脂糖微球的強度與其濃度成正相關,但濃度的提高又會帶來黏度的增加,造成乳化分散的難度進一步增加。筆者團隊通過自主研制多種高溫膜乳化設備,成功地在高黏度瓊脂糖體系上實現了粒徑從數微米至數十微米的調控,獲得了粒徑小于10微米的高強度均一瓊脂糖微球,大幅提高分辨率和分離速度。高強度、均一小粒徑瓊脂糖分離介質技術已轉讓并實施,系列蛋白質純化介質在全球上市,實現了分離速度3倍提升,分辨率1.5倍提升。
超大孔介質。針對超大生物分子尺寸大、結構復雜多變等特點開發的超大孔介質是另一類按需設計介質的典型代表。這一類介質同時具有擴散孔和貫穿孔,生物分子在介質內部通過對流和擴散進行流動,從而顯著提高傳質效率。通過反膠團溶脹法制備得到平均孔徑分別為120納米和280納米的超大孔DEAE-PSt離子交換介質,這種超大孔介質對乙肝疫苗病毒樣顆粒(HB-VLPs)的分離純化能力遠遠高于傳統瓊脂糖介質,不僅載量更高,而且超大孔結構能夠避免病毒樣顆粒(VLPs)的解聚,從而獲得更高的活性回收率;通過復乳液模板法制備孔徑達到1 000—3 000納米的超大孔介質,結合快速膜乳化技術,實現了大孔介質孔徑和粒徑均一可控的制備,這種介質適用于百納米級生物大分子,如流感病毒、狂犬病毒、噬菌體、外泌體等的高效分離純化。同時,該介質具有高機械強度和高流速的特點,能夠降低生物大分子純化的成本并提高分離的效率。
藥物遞送
勻速緩釋微球。微球作為蛋白質、多肽等生物藥的遞送載體,不僅可以保護藥物活性,還可通過調控藥物的釋放位置、釋放速率實現降低副作用、增加藥效的目的。采用微球包埋藥物,隨著微球的降解,藥物從微球內部被緩慢釋放出來,可實現降低給藥頻率、減小血藥濃度波動、延長有效血藥濃度維持時間。例如,艾塞那肽注射液每天注射2次,其長效微球制劑只需每周注射1次,給藥頻率大幅降低,血藥濃度穩定時間大幅延長。對于緩釋制劑,微球的粒徑大小及分布至關重要,直接決定藥物的釋放曲線。筆者團隊開展了以微球作為藥物載體的相關研究(表2),基于膜乳化先進制備技術,成功實現了多種粒徑均一微球的制備,并建成國際首條符合藥品生產質量管理規范的均一緩釋廣告設計微球的中試線和生產線,已獲得2個粒徑均一的緩釋微球藥品的臨床批件。
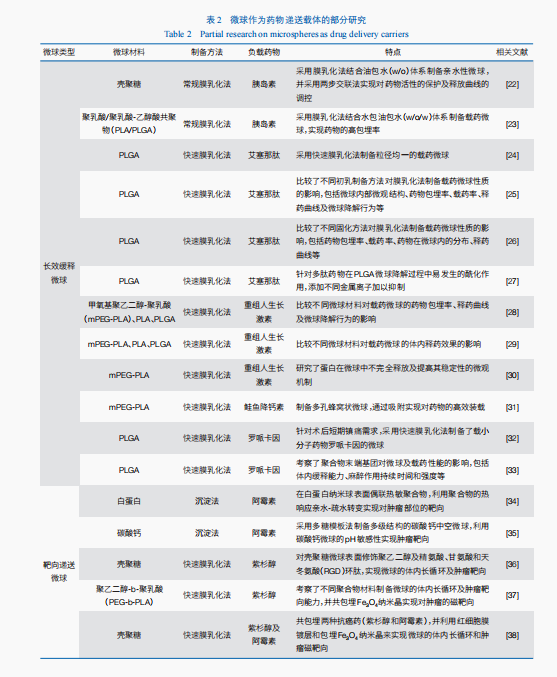
脈沖緩釋微球。對于某些藥物來說,勻速緩釋并不是最優的釋藥曲線,故脈沖釋放制劑也備受關注。以促骨細胞生成藥甲狀旁腺激素類似物特立帕肽為例,當特立帕肽每日血藥濃度高于內源甲狀旁腺激素濃度的時間不足4小時,藥物對骨的影響表現為促骨形成;當每日特立帕肽血藥濃度高于內源甲狀旁腺激素濃度的時間超過4小時,藥物對骨的影響表現為促骨吸收。因此,常規的勻速緩釋制劑用于特立帕肽的遞送時,難以滿足促骨形成的用藥需求,必須對微球載體進行合理化設計以實現藥物的脈沖釋放。筆者團隊在利用膜乳化技術實現對微球粒徑精準控制的基礎上,制備不同粒徑大小的均一微球,通過將不同粒徑的微球合理復配使用,可以有效地實現藥物的脈沖釋放。此外,筆者團隊通過對乳化工藝的調控,成功制備了同一粒徑、不同壁厚的中空微囊,通過對微囊的內部結構調控,同樣可以實現藥物的可控脈沖釋放,獲得具有不同脈沖模式的藥物載體。
自愈合大孔微球。生物藥物的活性易受外界環境影響。采用包埋法負載藥物時,所使用的有機溶劑及剪切力易造成藥物活性喪失;吸附法雖可以避免制備工藝對藥物活性的影響,但其負載率有限,且容易發生突釋。研究利用聚乳酸(PLA)較低的玻璃態轉化溫度,創制了一種自愈合大孔微球,該微球可以分散在藥物溶液中,在玻璃態轉化溫度下微球上的大孔發生閉合,將藥物包載在微球內部。這一創新的“后包埋”方法制備條件溫和、負載率高,可有效保護藥物活性,并且該微球還可與生物活性材料結合用于特殊部位的給藥。例如,玻璃體視網膜疾病是臨床上一類常見的眼部疾病,現有療法需要頻繁治療且AR擴增實境存在副作用,新興的細胞療法受制于體內細胞存活率低、病理環境下細胞表型不穩定、細胞產品保存條件苛刻等一系列難題而難以臨床應用。筆者團隊將外泌體與自愈合大孔微球結合,可以實現在尺寸、啟動儀式內部結構、分泌行為等方面對功能性細胞的模擬,同時可以在玻璃體內持續釋放活性外泌體,有利于長期發揮藥效。微球在玻璃體腔內注射后,可以向下沉降并滯留于玻璃體腔底部,避免了活細胞注射后懸浮于玻璃體腔而影響視線的問題。通過負載不同細胞來源的外泌體,該體系在治療視網膜細胞凋亡、眼內炎癥等疾病上均表現出良好的效果。
藥物靶向遞送載體。隨著技術的發展,依靠微球降解實現藥物緩釋這一釋藥模式已難以滿足多樣化的藥物遞送需求和應對體內的復雜環境。道具製作結構更為復雜、可以實現更為精準多樣釋藥模式的遞送載體得到了較大的關注,如具有自主動力、可通過導航和驅動實現動態靶向的遞送載體。美國加州理工學院高偉團隊開發出一種基于超聲驅動的水凝膠微型機器人用于大圖輸出藥物遞送,該載體具有獨特的雙開口氣泡捕獲腔結構,使其能夠在多種生物流體中均保持持續和有效的推進能力,并可與超聲成像技術結合,實現對載體運動和軌跡更精確的調控及跟蹤。另有一項研究構建了pH敏感的微馬達遞送載體,以實現腸道靶向給藥,研究者將具有pH敏感性的Eudragit®聚合物涂層涂覆到Mg-Au微馬達上,微馬廣告設計達在到達腸道后基于pH響應性可以實現載體的快速運動及藥物的完全釋放。
疫苗佐劑
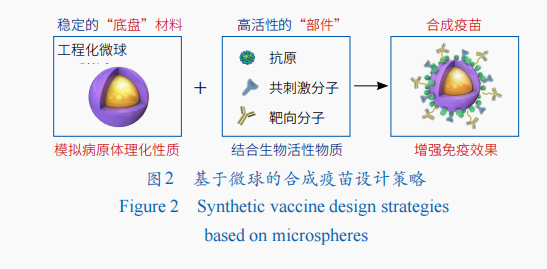
疫苗佐劑作為制劑中的重要組成部分,可以發揮增強免疫原性,調節抗體親和力、特異性和亞型分布,刺激細胞免疫應答,降低抗原劑量,減少接種頻率及提高老年、兒童等免疫功能不全者的應答成功率等作用。微球尤其是具有仿生特性的微球制劑是近年來疫苗佐劑的研究熱點之一,通過合理設計,微球制劑可模仿天然病原體的尺寸、電荷、形狀等物理特性,并可將抗原高密度裝載于表面,模仿病原體表面特征蛋白和危險信號分子的排布方式,提升抗原呈遞細胞(APC)對其的識別攝取效率。
筆者團隊提出了以微球作為疫苗“底盤”的合成疫苗工程的新思想,即用結構功能化微球模仿病毒、細菌等病原體,作為合成疫苗的“底盤”,與抗原等部件組裝,構建更穩定、高效且能大規模生產的人工合成疫苗(圖2)。基于對微球粒徑和形貌等性質的精準可控制備,可系統評價微球的粒徑、形狀、電荷等與細胞的相互作用和對細胞的免疫增強效果。正電荷微球可通過質子海綿效應促進抗原的溶酶體逃逸以提高細胞免疫應答,通過對微球表面電荷的調節,可得到多種溶酶體逃逸型微球佐劑,顯著提高細胞免疫應答。除發揮遞送抗原的作用外,微球在注射部位的緩慢VR虛擬實境降解還可形成有利于APC的募集、細胞因子分泌和抗原交叉提呈的局部免疫微環境,實現長效的免疫應答。
將微球與乳液結合,還可以在常規剛性微球的基礎上加以突破,得到一類特殊的柔性制劑Pickering乳液。這類制劑由微球穩定的乳液組成,可模仿天然病原體的黏彈特性,在與APC接觸時,發生應力學形變將接觸區域從點擴大到面,獲得較大的免疫識別界面。同時,抗原分布于界面,可在微球縫隙間自由流動,向制劑與細胞接觸區域富集,進一步強化免疫識別和細胞攝取。用這種方法構建的禽流感及腫瘤疫苗免疫效果遠優于已有疫苗。目前,多種生物相容性微球已被應用于Pickering乳液制備,例如聚乳酸-乙醇酸共聚物(PLGA)、殼聚糖、白蛋白等,通過微球性質的改變進一步提升和拓展了免疫增強性能。例如,采用白蛋白顆粒制備的Pickering乳液,還可通過柔性形變自適應間質細胞20—100納米的間隙,從而變形穿過細胞縫隙,達到組織滲透的目的,顯著提升了淋巴結遞送效率和免疫應答效果,為疫苗富集至淋巴結提供了新策略。
在對Pickering乳液研究的過程中,筆者團隊還發現微球在乳液上的分布位置直接影響其免疫效果及免疫偏向。當微球分布在乳液外水相中時,微球與乳液的協同作用最弱,免疫增強效果不明顯;微球分布在乳液油水界面的Pickering乳液組,具有Th1型免疫偏向,在增強體液免疫的同時,可顯著增強細包裝盒胞免疫應答;微球分布在乳液內水相的復乳組,其具有Th2型免疫偏向,在增強體液免疫應答、實現長效免疫方面的優勢更為明顯。
微球應用與發展建議
變革性規模化制造技術
在生物制藥領域,微球的應用領域仍由國外占據引領地位。例如,細胞培養微載體、分離介質和緩釋微球等產品均由國外最早發明并付諸產業化。國外行業早期的布局和多年的積累導致我國在微球的應用方面仍存在不自信的問題,盲目相信進口,相關科研單位和企業每年花大量經費購買微載體、分離介質等。這一現狀既不利于擺脫國外壟斷,也不利于我國生物制藥的行業發展。目前,我國微球技術發展應重視以下2個方面:創新制備技術的應用可以有效提升現有微球的性能。通過對微球性能的提升和應用的拓展,可以實現彎道超車,完成對現有微球的替代。例如,3D打印技術可以制備除傳統球形外多種復雜形貌、結構的微球,滿足不同的應用需求。創新制備技術的發展必須關注放大可能性。眾多先進的制備技術已經在實驗室研究中應用,但國內的微球工業制備目前仍多采用機械攪拌、均質乳化等傳統分散技術,放大效應的存在導致多數制備技術難以放大,放大技術和配套設備是橫亙在成果轉化之間的最大障礙。
中國科學院過程工程研究所多年來深耕微孔膜乳化技術,建立了國際領先的尺寸均一可控、結構可調的微球精準制造技術,自主研發了高通量膜乳化器,實現了加料、乳液制備、乳滴質控、乳滴聚合及后處理等全過程的計算機控制和數據記錄、集成;所制備的液滴均勻性、重復性好;設策展備能自動控制,操作簡便,運行平穩,可以用于多種乳液及微球的制備。尤其是在生物制藥行業,該設備可減少人工操作及染菌風險,為微球制劑的臨床申報奠定了基礎。目前,已有2個均一可降解微球新型藥物制劑依托這一設備和技術獲得臨床批件。
人工智能指導的全新設計理念
對于生物制藥中的微球設計,人工智能同樣可以發揮巨大潛能。以藥物遞送中的微球制劑為例,以往制劑的優化需要通過大量的濕實驗進行,通過大量的試錯循環不斷調整配方,逐步達到期望的藥物遞送效果及釋放特性。這是研發過程中最為耗時耗力的階段。由于配方與結果之間的道具製作相關性往往并不明確,規律預測困難,僅能依靠經驗進行半定量摸索調試,因此往往會陷入“配方調控→制備→載藥量→體外釋放”的迭代循環模式。此外,由于體外釋放與體內釋放之間無明確映射關系,往往在完成上一輪迭代實驗之后,又需要繼續“體內釋放→配方調控”的重復調整。借助人工智能的幫助,綜合大量文獻及臨床數據,提取關鍵特征,可建立大數據平臺和人工智能預測平臺,構建開幕活動貼合實際研發過程的緩釋微球系統性數據集,并基于機器學習算法,對藥物釋放數據進行大量訓練,實現由配方到釋放的精準預測,精準調控釋藥模式,極大提升研發速度并減少研發成本。
建立健全評價手段及質量標準,實現高質量規范創新
微球作為生物制藥中的重要核心技術,其質量事關人民健康安全,在實際應用前必須建立健全完備且科學的評價手段及質量標準。我國生物醫藥起步較晚,在實際應用中微球產品相關的標準較少,且在已有產品的效果評價和標準制定方面多參考國外范例;對于分離介質、藥物制劑等原始創新的產品缺少標準參考,限制了國產微球材料的發展。2019年,中國科學院過程工程研究所生化工程國家重點實驗室聯合中國標準化研究院、中科森輝微球技術(蘇州)有限公司,共同制定了我國首批瓊脂糖微球分離介質國家標準,為我國分離介質行業的產品研發、生產和應用推廣提供了統一、規范的檢測方法支持和產品質量控制依據,有利于規范行業發展,提高產品質量和市場競爭力。只有重視先進評價手段和規范質量標準的建立,才能有效有序地引領我國微球材料高質量規范創新發展,為微球在生物制藥中的應用保駕護航,推動我國向科技創新驅動藥品研發的范式轉型,助力醫藥工業由中國制造邁向中國創造。
(作者:吳頡、周煒清、趙嵐、馬光輝,中國科學院過程工程研究所 中國科學院大學化學工程學院。《中國科學院院刊》供稿)
發佈留言